Účinné látky: Omeprazol
Mepral 40 mg prášek pro infuzní roztok
Příbalové letáky Mepral jsou k dispozici pro velikosti balení:- Mepral 10 mg enterosolventní tvrdé tobolky, Mepral 20 mg enterosolventní tvrdé tobolky, Mepral 40 mg enterosolventní tvrdé tobolky
- Mepral 40 mg prášek pro infuzní roztok
Indikace Proč se používá Mepral? K čemu to je?
Mepral obsahuje léčivou látku omeprazol. Patří do skupiny léků nazývaných „inhibitory protonové pumpy“, které působí snížením množství kyseliny produkované žaludkem.
Mepral prášek pro infuzní roztok lze použít jako alternativu k orální terapii.
Kontraindikace Kdy by Mepral neměl být používán
Nesmíte dostat Mepral
- Jestliže jste alergický / á (přecitlivělý / á) na omeprazol nebo na kteroukoli další složku přípravku Mepral.
- Jestliže jste alergický (á) na léky obsahující jiné inhibitory protonové pumpy (např. Pantoprazol, lansoprazol, rabeprazol, esomeprazol).
- Pokud užíváte lék obsahující nelfinavir (používá se k infekci HIV).
Pokud si nejste jisti, poraďte se se svým lékařem, zdravotní sestrou nebo lékárníkem dříve, než vám bude tento přípravek podán.
Opatření pro použití Co potřebujete vědět, než začnete Mepral užívat
Mepral může skrývat příznaky jiných nemocí. Pokud se tedy před užitím přípravku Mepral nebo po něm setkáte s příznaky popsanými níže, okamžitě kontaktujte svého lékaře:
- Nemotivované hubnutí a problémy s polykáním.
- Bolest žaludku nebo poruchy trávení.
- Zvracení jídla nebo krve.
- Tmavé zabarvení stolice (přítomnost krve ve stolici).
- Těžký nebo přetrvávající průjem, protože omeprazol je spojován s mírným nárůstem nakažlivého průjmu.
- Závažné problémy s játry.
Interakce Které léky nebo potraviny mohou změnit účinek přípravku Mepral
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte nebo jste v nedávné době užíval, a to i o lécích, které jsou dostupné bez lékařského předpisu. To je důležité, protože přípravek Mepral může ovlivnit způsob, jakým některé léky účinkují, a některé léky mohou ovlivnit účinek přípravku Mepral.
Mepral vám nesmí být podán, pokud užíváte lék obsahující nelfinavir (používaný k léčbě infekcí HIV).
Informujte svého lékaře nebo lékárníka, pokud užíváte jeden nebo více z následujících léků:
- Ketokonazol, itrakonazol nebo vorikonazol (používané k léčbě infekcí způsobených houbami)
- Digoxin (používá se k léčbě srdečních problémů)
- Diazepam (používá se k léčbě úzkosti, k uvolnění svalů nebo k epilepsii).
- Fenytoin (používá se k léčbě epilepsie) Pokud užíváte fenytoin, lékař vás bude sledovat na začátku a na konci léčby přípravkem Mepral.
- Léky používané k ředění krve, jako je warfarin nebo jiné blokátory vitaminu K. Váš lékař vás bude sledovat na začátku a na konci léčby přípravkem Mepral.
- Rifampicin (používá se k léčbě tuberkulózy)
- Atazanavir (používá se k léčbě infekce HIV)
- Takrolimus (používá se při transplantacích orgánů)
- Třezalka tečkovaná (Hypericum perforatum) (používá se k léčbě mírné deprese)
- Cilostazol (používá se k léčbě přerušované klaudikace)
- Saquinavir (používá se k léčbě infekce HIV)
- Clopidogrel (používá se k prevenci krevních sraženin (trombů))
- Erlotinib (používá se k léčbě rakoviny)
- Methotrexát (chemoterapeutický lék používaný ve vysokých dávkách k léčbě rakoviny) - pokud užíváte methotrexát ve vysokých dávkách, může váš lékař léčbu přípravkem Mepral dočasně zastavit.
Pokud vám lékař předepsal amoxicilinová a klarithromycinová antibiotika společně s Mepralem k léčbě vředů způsobených infekcí Helicobacter pylori, je velmi důležité, abyste ohlásili, zda užíváte nějaké další léky.
Užívání Mepralu s jídlem a pitím
Tobolky lze užívat s jídlem nebo na prázdný žaludek.
Varování Je důležité vědět, že:
Těhotenství a kojení
Před užitím přípravku Mepral informujte svého lékaře, pokud jste těhotná nebo chcete otěhotnět. Váš lékař rozhodne, zda můžete Mepral během této doby užívat. Váš lékař rozhodne, zda můžete Mepral užívat, pokud kojíte.
Řízení dopravních prostředků a obsluha strojů
Je nepravděpodobné, že by Mepral ovlivňoval Vaši schopnost řídit nebo obsluhovat nástroje nebo stroje. Mohou se objevit nežádoucí účinky jako závratě a poruchy vidění (viz bod 4). Pokud tím trpíte, neměli byste řídit ani obsluhovat stroje.
Dávka, způsob a doba podání Jak používat Mepral: Dávkování
- Mepral lze podávat dospělým pacientům, včetně starších osob.
- Zkušenosti s intravenózním použitím přípravku Mepral u dětí jsou omezené.
Podávání Mepralu
- Mepral vám podá lékař, který rozhodne, jaké množství léku potřebujete.
- Lék vám bude podán jako infuze do žíly.
Předávkování Co dělat, když jste užil příliš mnoho přípravku Mepral
Jestliže jste dostal (a) více přípravku Mepral, než jste měl (a)
Pokud si myslíte, že jste dostali příliš mnoho přípravku Mepral, okamžitě to sdělte svému lékaři.
Nežádoucí účinky Jaké jsou vedlejší účinky přípravku Mepral
Podobně jako všechny léky, může mít i Mepral nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Pokud zaznamenáte některý z následujících vzácných, ale závažných nežádoucích účinků, přestaňte Mepral užívat a okamžitě kontaktujte svého lékaře:
- Náhlé sípání, otok rtů, jazyka a hrdla nebo těla, vyrážka, mdloby nebo potíže s polykáním (závažná alergická reakce).
- Zčervenání kůže s puchýři nebo odlupováním. Mohou se také objevit závažné puchýře s krvácením rtů, očí, úst, nosu a genitálií. Může to být „Stevens-Johnsonův syndrom“ nebo „toxická epidermální nekrolýza“.
- Žlutá kůže, tmavá moč a únava mohou být příznaky jaterních problémů.
Nežádoucí účinky se mohou vyskytovat s určitou frekvencí, jak je definováno níže:
Velmi časté: postihují více než 1 z 10 pacientů
Časté: postihují 1 až 10 uživatelů ze 100
Méně časté: postihují 1 až 10 uživatelů z 1 000
Vzácné: postihují 1 až 10 uživatelů z 10 000
Velmi vzácné: postihují méně než 1 z 10 000 pacientů
Není známo: frekvenci nelze z dostupných údajů určit
Mezi další nežádoucí účinky patří:
Časté nežádoucí účinky
- Bolest hlavy.
- Účinky na žaludek nebo střeva: průjem, bolest žaludku, zácpa, plynatost (plynatost).
- Pocit na zvracení (nauzea) nebo zvracení (zvracení).
Méně časté nežádoucí účinky
- Otok nohou a kotníků.
- Zhoršený spánek (nespavost).
- Závratě, brnění, pocit ospalosti.
- Pocit točení (vertigo).
- Změny krevních testů související s funkcí jater.
- Vyrážka, vyrážka s otokem kůže (kopřivka) a svědění kůže.
- Celkový pocit nevolnosti a nedostatku energie.
- Pokud užíváte inhibitor protonové pumpy, jako je Mepral, zejména déle než jeden rok, můžete mít mírně zvýšené riziko zlomeniny kyčle, zápěstí nebo páteře. Pokud máte osteoporózu nebo užíváte kortikosteroidy (což může zvýšit riziko osteoporóza) poraďte se se svým lékařem.
Vzácné nežádoucí účinky
- Změny ve složení krve, jako je snížení počtu bílých krvinek nebo krevních destiček. To může způsobit slabost a snadné podlitiny nebo může zvýšit pravděpodobnost infekcí.
- Alergické reakce, někdy velmi závažné, včetně otoků rtů, jazyka a hrdla, horečky, sípání.
- Nízké hladiny sodíku v krvi. To může způsobit slabost, zvracení a křeče.
- Pocit rozrušení, zmatenosti nebo deprese.
- Změny chuti.
- Problémy se zrakem, jako je rozmazané vidění.
- Náhlé sípání nebo dušnost (bronchospasmus).
- Suchá ústa
- Zánět uvnitř úst.
- Infekce zvaná „drozd“, která může postihnout střevo a je způsobena houbou.
- Problémy s játry, včetně žloutenky, která může způsobit žlutou kůži, tmavou moč a únavu.
- Vypadávání vlasů (alopecie).
- Kožní vyrážka při vystavení slunci.
- Bolest kloubů (artralgie) nebo bolest svalů (myalgie).
- Závažné problémy s ledvinami (intersticiální nefritida).
- Zvýšené pocení.
Velmi vzácné nežádoucí účinky
- Změny v počtech krvinek, včetně agranulocytózy (nedostatek bílých krvinek)
- Agrese.
- Vidět, cítit nebo slyšet o neskutečných událostech (halucinace).
- Závažné problémy s játry až do selhání jater a zánětu mozku.
- Náhlý nástup závažné vyrážky nebo puchýřů a olupování kůže. Tyto účinky mohou být spojeny s vysokou horečkou a bolestmi kloubů (multiformní erytém, Stevens-Johnsonův syndrom, toxická epidermální nekrolýza)
- Svalová slabost.
- Zvětšení hrudníku u mužů.
Neznámý
- Zánět střeva (vedoucí k průjmu).
- Pokud užíváte Mepral déle než tři měsíce, může dojít ke snížení hladiny hořčíku v krvi. Nízká hladina hořčíku se může projevit únavou, nedobrovolnými svalovými stahy, dezorientací, křečemi, závratěmi, zvýšenou srdeční frekvencí. Pokud máte některý z těchto příznaků, okamžitě se poraďte se svým lékařem. Nízké hladiny hořčíku mohou také vést ke snížení hladiny draslíku nebo vápníku v krvi. Váš lékař by měl rozhodnout, zda vám bude pravidelně kontrolovat hladinu hořčíku v krvi.
- Snížení hladiny vápníku v krvi (hypokalcemie). Snížení hladiny vápníku v krvi může být důsledkem velmi nízkých hladin hořčíku.
V některých ojedinělých případech bylo hlášeno ireverzibilní poškození zraku u těžce nemocných pacientů léčených omeprazolem intravenózní injekcí, zejména ve vysokých dávkách, ale nebyla zjištěna příčinná souvislost s léčivem.
Ve velmi vzácných případech může Mepral postihnout bílé krvinky vedoucí k imunitní nedostatečnosti. Pokud se u vás objeví infekce s příznaky, jako je horečka s vážným zhoršením celkového zdravotního stavu nebo horečka s příznaky lokální infekce, jako je bolest v krku, krku nebo v ústech nebo potíže s močením, měli byste co nejdříve navštívit svého lékaře. vyloučit nedostatek bílých krvinek (agranulocytózu) provedením krevního testu Je důležité, abyste v tomto případě sdělili svému lékaři, jaký lék užíváte.
Nebojte se seznamu možných vedlejších účinků. Může se stát, že se u vás žádný neobjeví. Pokud některý z nežádoucích účinků začne být závažný, nebo pokud si všimnete jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci, sdělte to prosím svému lékaři nebo lékárníkovi.
Hlášení nežádoucích účinků
Pokud se u vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků
Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku
Expirace a retence
- Uchovávejte Mepral mimo dosah a dohled dětí.
- Nepoužívejte Mepral po uplynutí doby použitelnosti, uvedené na obalu za EXP. Datum exspirace se vztahuje k poslednímu dni v měsíci.
- Uchovávejte při teplotě do 25 ° C. Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
- Doba použitelnosti po rekonstituci:
Rekonstituovaný infuzní roztok chloridu sodného 9 mg / ml (0,9%) by měl být použit do 12 hodin od přípravy. Rekonstituovaný infuzní roztok s glukózou 50 mg / ml (5%) by měl být použit do 6 hodin od přípravy.
Z mikrobiologického hlediska by měl být přípravek použit okamžitě, pokud rekonstituce neproběhla za validovaných a kontrolovaných aseptických podmínek.
- Léčivé přípravky se nesmí vyhazovat do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Pomůže to chránit životní prostředí.
Co Mepral obsahuje
- Léčivou látkou je omeprazol. Jedna injekční lahvička prášku pro infuzní roztok obsahuje sodnou sůl omeprazolu, což odpovídá 40 mg omeprazolu.
- Dalšími složkami jsou edetan sodný a hydroxid sodný.
Jak Mepral vypadá a obsah balení
Mepral 40 mg prášek pro infuzní roztok (prášek pro infuzi) je obsažen v injekční lahvičce.
Ze suchého prášku obsaženého v lahvičce se před podáním vytvoří roztok
Velikosti balení: lahvičky 1x40 mg, 5x40 mg a 10x40 mg.
Na trhu nemusí být všechny velikosti balení.
Následující informace jsou určeny pouze pro zdravotnické pracovníky:
Celý obsah každé lahvičky by měl být rozpuštěn přibližně v 5 ml a okamžitě zředěn ve 100 ml. Měl by být použit infuzní roztok chloridu sodného 9 mg / ml (0,9%) nebo infuzní roztok glukózy 50 mg / ml (5%) stabilita omeprazolu je ovlivněna pH infuzního roztoku, proto je třeba se vyvarovat použití jiných rozpouštědel nebo objemů k ředění.
Příprava
- Odeberte 5 ml infuzního roztoku z lahve nebo 100 ml vaku injekční stříkačkou.
- Přeneste toto množství do lahvičky obsahující lyofilizovaný omeprazol, dobře protřepejte a ujistěte se, že je omeprazol zcela rozpuštěn.
- Natáhněte roztok omeprazolu získaný injekční stříkačkou.
- Přeneste roztok do infuzního vaku nebo lahve.
- Opakujte kroky 1-4, abyste zajistili, že veškeré množství omeprazolu bylo přeneseno z lahvičky do infuzního vaku nebo lahve.
Alternativní infuzní přípravky v pružných nádobách
- Použijte oboustrannou přenosovou jehlu a připojte ji k injekční membráně infuzního vaku. Připojte druhý konec jehly k injekční lahvičce obsahující lyofilizovaný omeprazol.
- Omeprazol rozpusťte pumpováním infuzního roztoku mezi infuzní vak a láhev.
- Ujistěte se, že je omeprazol zcela rozpuštěn.
Infuzní roztok by měl být podáván jako intravenózní infuze trvající 20-30 minut.
Zdroj příbalové informace: AIFA (Italská agentura pro léčivé přípravky). Obsah zveřejněný v lednu 2016. Přítomné informace nemusí být aktuální.
Chcete-li mít přístup k nejaktuálnější verzi, doporučujeme navštívit webovou stránku AIFA (Italská agentura pro léčivé přípravky). Prohlášení a užitečné informace.
01.0 NÁZEV LÉČIVÉHO PŘÍPRAVKU
MEPRAL
02.0 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna injekční lahvička obsahuje omeprazolum natricum 42,6 mg, což odpovídá omeprazolum 40 mg. Po rekonstituci obsahuje 1 ml 0,426 mg sodné soli omeprazolu, což odpovídá 0,4 mg omeprazolu.
Úplný seznam pomocných látek viz bod 6.1.
03.0 LÉKOVÁ FORMA
Prášek pro infuzní roztok (prášek pro infuzi)
Rozsah pH v glukóze je přibližně 8,9 - 9,5 a rozmezí pH v 0,9% chloridu sodném je 9,3 - 10,3.
04.0 KLINICKÉ INFORMACE
04.1 Terapeutické indikace
Mepral pro intravenózní podání je indikován jako alternativa k orální terapii pro následující indikace:
Dospělí
• Léčba dvanáctníkových vředů
• Prevence recidivy duodenálních vředů
• Léčba žaludečních vředů
• Prevence recidivy žaludečních vředů
• Vymýcení Helicobacter pylori (H. pylori) při peptickém vředu ve spojení s vhodnou antibiotickou terapií
• Léčba žaludečních a dvanáctníkových vředů spojených s používáním NSAID
• Prevence žaludečních a dvanáctníkových vředů spojených s používáním NSAID u rizikových pacientů
• Léčba refluxní ezofagitidy
• Dlouhodobá léčba pacientů se zhojenou refluxní ezofagitidou
• Léčba symptomatické refluxní choroby jícnu
• Léčba Zollinger-Ellisonova syndromu
04.2 Dávkování a způsob podání
Dávkování
Alternativa k orální terapii
Použití Mepralu IV 40 mg jednou denně se doporučuje u pacientů, u nichž je orální podávání nedostatečné. U pacientů se Zollingerovým-Ellisonovým syndromem je doporučená počáteční dávka intravenózního Mepralu 60 mg denně. • Mohou být požadovány vyšší denní dávky, dávka by měla být individuálně upravena. Pokud dávka překročí 60 mg denně, dávka by měla být rozdělena do dvou denních dávek.
Mepral by měl být podáván jako intravenózní infuze trvající 20-30 minut.
Pokyny k rekonstituci přípravku před podáním viz bod 6.6.
Zvláštní populace
Porucha funkce ledvin
U pacientů s poruchou funkce ledvin není nutná úprava dávkování (viz bod 5.2).
Zhoršená funkce jater
U pacientů s poruchou funkce jater může stačit denní dávka 10–20 mg (viz bod 5.2).
Starší osoby (> 65 let)
U starších pacientů není úprava dávky nutná (viz bod 5.2).
Pediatrická populace
Zkušenosti s intravenózním použitím přípravku Mepral u dětí jsou omezené.
04.3 Kontraindikace
Přecitlivělost na omeprazol, benzimidazolové náhražky nebo na kteroukoli pomocnou látku.
Omeprazol, stejně jako ostatní inhibitory protonové pumpy (PPI), by neměl být podáván současně s nelfinavirem (viz bod 4.5).
04.4 Zvláštní upozornění a vhodná opatření pro použití
Za přítomnosti alarmujících symptomů (např. Významná neúmyslná ztráta hmotnosti, opakující se zvracení, dysfagie, hemateméza nebo meléna) a při podezření nebo potvrzení přítomnosti žaludečního vředu by měla být vyloučena maligní povaha vředu. Jako symptomatická reakce na terapie může oddálit správnou diagnózu.
Současné podávání atazanaviru a inhibitorů protonové pumpy se nedoporučuje (viz bod 4.5). Pokud je kombinace atazanaviru a inhibitoru protonové pumpy považována za nevyhnutelnou, doporučuje se pečlivé klinické sledování (např. Virová nálož) v kombinaci se zvýšením dávky atazanaviru na 400 mg se 100 mg ritonaviru; dávka omeprazolu nesmí překročit 20 mg.
Omeprazol, stejně jako všechny léky potlačující kyseliny, může snížit absorpci vitaminu B12 (kyanokobalamin) v důsledku hypo- nebo achlorhydrie. To je třeba vzít v úvahu u pacientů s nízkými rezervami nebo rizikovými faktory pro sníženou absorpci vitamínů. B12 v případě dlouhodobého -termální terapie.
Omeprazol je inhibitor CYP2C19. Při zahájení nebo na konci léčby omeprazolem je třeba zvážit potenciální interakci s léky metabolizovanými CYP2C19. Byla pozorována interakce mezi klopidogrelem a omeprazolem (viz bod 4.5). Klinický význam této interakce je nejistý. Jako preventivní opatření by se mělo zabránit souběžnému užívání klopidogrelu a omeprazolu.
Léčba inhibitory protonové pumpy může způsobit mírně zvýšené riziko gastrointestinálních infekcí od Salmonella ACampylobacter (viz bod 5.1).
Bylo pozorováno, že inhibitory protonové pumpy (PPI), jako je omeprazol, způsobují závažnou hypomagnezémii u pacientů léčených po dobu nejméně tří měsíců a v mnoha případech po dobu jednoho roku. Mezi závažné příznaky hypomagnezémie patří únava, tetanie, delirium, křeče, závratě a ventrikulární arytmie. Zpočátku se mohou projevovat zákeřně a být opomíjeni. Hypomagnezémie se u většiny pacientů zlepšuje po užívání hořčíku a vysazení inhibitoru protonové pumpy. Zdravotničtí pracovníci by měli zvážit měření hladin hořčíku před zahájením léčby PPI a pravidelně během léčby. Léčba u pacientů dlouhodobě léčených nebo léčených digoxinem nebo léky, které mohou způsobit hypomagnezémii (např. diuretika).
Inhibitory protonové pumpy, zvláště pokud se používají ve vysokých dávkách a delší dobu (> 1 rok), mohou způsobit mírně zvýšené riziko zlomenin kyčle, zápěstí a páteře, zejména u starších pacientů nebo v přítomnosti dalších známých rizikových faktorů. naznačují, že inhibitory protonové pumpy mohou zvýšit celkové riziko zlomenin o 10% až 40%. Toto zvýšení může být částečně způsobeno jinými rizikovými faktory. Pacienti s rizikem osteoporózy by měli dostávat léčbu podle současných pokynů pro klinickou praxi a musí přijmout „adekvátní“ množství vitaminu D a vápníku.
Stejně jako u všech dlouhodobých léčebných postupů, zvláště pokud je délka léčby delší než 1 rok, by měli být pacienti pravidelně sledováni.
04.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Vliv omeprazolu na farmakokinetiku jiných léčivých látek
Aktivní složky s absorpcí závislou na pH
Během léčby omeprazolem může být absorpce léčivých látek závislá na pH žaludku zvýšena nebo snížena sníženou intragastrickou kyselostí.
Nelfinavir, atazanavir
Při současném podávání omeprazolu se plazmatické hladiny nelfinaviru a atazanaviru snižují.
Současné podávání omeprazolu a nelfinaviru je kontraindikováno (viz bod 4.3). Současné podávání omeprazolu (40 mg jednou denně) snížilo průměrnou expozici nelfinaviru přibližně o 40% a snížilo průměrnou expozici farmakologicky aktivního metabolitu M8 přibližně o 75-90%. Interakce může také zahrnovat inhibici CYP2C19.
Současné podávání omeprazolu a atazanaviru se nedoporučuje (viz bod 4.4). Souběžné podávání omeprazolu (40 mg jednou denně) a atazanaviru 300 mg / ritonaviru 100 mg zdravým dobrovolníkům mělo za následek 75% snížení expozice atazanaviru. Zvýšení dávky atazanaviru na 400 mg nevyrovnalo dopad omeprazolu na expozici atazanaviru . Souběžné podávání omeprazolu (20 mg jednou denně) a atazanaviru 400 mg / ritonaviru 100 mg zdravým dobrovolníkům mělo za následek přibližně 30% snížení expozice atazanaviru ve srovnání s atazanavirem 300 mg / ritonavirem 100 mg jednou denně.
Digoxin
Souběžná léčba omeprazolem (20 mg / den) a digoxinem u zdravých subjektů vedla k 10% zvýšení biologické dostupnosti digoxinu. Toxicita digoxinu byla hlášena zřídka. Při používání vysokých dávek omeprazolu u starších pacientů se však doporučuje opatrnost.Mělo by být proto zvýšeno terapeutické sledování digoxinu.
Clopidogrel
V zkřížené klinické studii byl klopidogrel (nasycovací dávka 300 mg následovaný 75 mg / den) podáván po dobu 5 dnů v monoterapii a s omeprazolem (80 mg podávaných společně s klopidogrelem). Expozice aktivnímu metabolitu klopidogrelu se snížila o 46% (1. den) a 42% (5. den) při současném podávání klopidogrelu a omeprazolu. Při současném podávání klopidogrelu a omeprazolu došlo ke snížení o 47% (24 hodin) a 30% (5. den) průměrné inhibice agregace krevních destiček (PAH). V jiné studii bylo prokázáno, že podávání klopidogrelu a omeprazolu v různých časech nezabrání jejich interakci, která se zdá být způsobena inhibičním účinkem omeprazolu na CYP2C19 . Byly hlášeny nekonzistentní údaje z observačních a klinických studií o klinických důsledcích této farmakokinetické / farmakodynamické interakce z hlediska závažných kardiovaskulárních příhod.
Další účinné látky
Absorpce posakonazolu, erlotinibu, ketokonazolu a itrakonazolu je významně snížena, a proto může být snížena klinická účinnost. Je třeba se vyhnout souběžnému podávání posakonazolu a erlotinibu.
Účinné látky metabolizované CYP2C19
Omeprazol je středně silným inhibitorem jeho hlavního metabolizujícího enzymu, CYP2C19. Proto může být metabolismus souběžně léčivých látek také metabolizovaných CYP2C19 snížen a systémová expozice těmto látkám zvýšena. Příklady takových léků jsou R-warfarin a další antagonisté vitaminu K, cilostazol, diazepam a fenytoin.
Cilostazol
Omeprazol podávaný v dávce 40 mg zdravým dobrovolníkům v křížové studii zvýšil Cmax cilostazolu o 18% respektive 26% a jednoho z jeho aktivních metabolitů o 29%, respektive 69%. ...
Fenytoin
Během prvních dvou týdnů po zahájení léčby omeprazolem se doporučuje monitorování plazmatické koncentrace fenytoinu, a pokud je nutná úprava dávky fenytoinu, doporučuje se při ukončení léčby omeprazolem sledovat a dále upravovat dávku.
Mechanismus neznámý
Saquinavir
Souběžné podávání omeprazolu a sachinaviru / ritonaviru vedlo ke zvýšení plazmatických hladin sachinaviru až o přibližně 70% s dobrou snášenlivostí u HIV pozitivních pacientů.
Takrolimus
Bylo hlášeno, že současné podávání omeprazolu zvyšuje sérové hladiny takrolimu. Je třeba zvýšit monitorování koncentrací takrolimu a renálních funkcí (clearance kreatininu) a v případě potřeby upravit dávkování takrolimu.
Methotrexát
Při současném podávání s inhibitory protonové pumpy bylo u některých pacientů hlášeno zvýšení hladin methotrexátu. Pokud je methotrexát podáván ve vysokých dávkách, mělo by být zváženo dočasné vysazení omeprazolu.
Vliv dalších léčivých látek na farmakokinetiku omeprazolu
Inhibitory CYP2C19 a / nebo CYP3A4
Jelikož je omeprazol metabolizován CYP2C19 a CYP3A4, léčivé látky inhibující CYP2C19 nebo CYP3A4 (jako je klarithromycin a vorikonazol) mohou zvýšit sérové hladiny omeprazolu a snížit jeho rychlost metabolismu. Souběžné podávání vorikonazolu má za následek více než dvojnásobnou expozici omeprazolu. Vzhledem k tomu, že podávání vysokých dávek omeprazolu bylo dobře tolerováno, není obecně nutná úprava dávky omeprazolu. U pacientů s těžkou poruchou funkce jater je však třeba dávku upravit. a v případě dlouhodobé léčby.
Induktory CYP2C19 a / nebo CYP3A4
Účinné látky indukující CYP2C19 nebo CYP3A4 nebo obojí (jako rifampicin a třezalka tečkovaná) mohou způsobit snížení sérových hladin omeprazolu, což zvyšuje jeho rychlost metabolismu.
04.6 Těhotenství a kojení
Výsledky tří prospektivních epidemiologických studií (více než 1 000 exponovaných výsledků pacientů) nenaznačují žádné nežádoucí účinky omeprazolu na těhotenství nebo zdraví plodu / novorozence. Omeprazol lze užívat během těhotenství.
Omeprazol se vylučuje do mateřského mléka, ale je nepravděpodobné, že by ovlivňoval kojence, pokud je podáván v terapeutických dávkách.
04.7 Účinky na schopnost řídit a obsluhovat stroje
Je nepravděpodobné, že by Mepral ovlivňoval schopnost řídit nebo obsluhovat stroje. Mohou se objevit nežádoucí účinky jako závratě a poruchy vidění (viz bod 4.8). Pokud tím trpí, pacienti by neměli řídit ani obsluhovat stroje.
04.8 Nežádoucí účinky
Nejčastějšími vedlejšími účinky (1–10% pacientů) jsou bolesti hlavy, břicha, zácpa, průjem, plynatost a nevolnost / zvracení.
Následující nežádoucí účinky, identifikované nebo podezřelé, byly zdůrazněny během klinických studií s omeprazolem a po uvedení na trh. V žádném případě nebyla stanovena korelace s podanou dávkou léčiva. Níže uvedené nežádoucí účinky jsou klasifikovány podle frekvence a systému klasifikace orgánů (SOC). Třídy frekvencí jsou definovány pomocí následující konvence: velmi časté (≥ 1/10), časté (≥ 1/100 až
V některých ojedinělých případech bylo hlášeno ireverzibilní poškození zraku u těžce nemocných pacientů léčených omeprazolem intravenózní injekcí, zejména ve vysokých dávkách, ale nebyla zjištěna příčinná souvislost s léčivem.
04.9 Předávkování
O předávkování omeprazolem u lidí jsou k dispozici omezené informace. V literatuře byly hlášeny dávky až 560 mg a občas byly hlášeny jednorázové perorální dávky až 2 400 mg omeprazolu (120násobek obvykle doporučené klinické dávky). bylo hlášeno zvracení, závratě, bolest břicha, průjem a bolest hlavy a v jednotlivých případech byla také pozorována apatie, deprese a zmatenost.
Popsané příznaky byly přechodné a nebyly hlášeny žádné vážné důsledky. Rychlost eliminace se nemění s rostoucími dávkami (kinetika prvního řádu). Léčba je v případě potřeby symptomatická.
Intravenózní podání dávek až 270 mg za jeden den a až 650 mg podávaných po dobu tří dnů během klinických studií nezpůsobilo nežádoucí účinky závislé na dávce.
05.0 FARMAKOLOGICKÉ VLASTNOSTI
05.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: inhibitory protonové pumpy.
ATC kód: A02BC01.
Mechanismus účinku
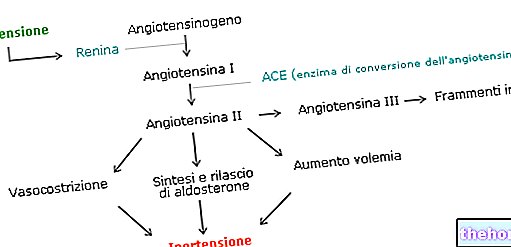
Omeprazol, racemická směs dvou enantiomerů, snižuje sekreci žaludeční kyseliny vysoce specializovaným mechanismem účinku. je specifickým inhibitorem protonové pumpy na úrovni parietálních buněk žaludku. Působí rychle a podporuje reverzibilní kontrolu inhibice sekrece žaludeční kyseliny jediným denním podáním.
Omeprazol je slabá báze a koncentruje se a převádí na aktivní formu ve vysoce kyselém prostředí intracelulárních kanálků v parietálních buňkách, kde inhibuje protonovou pumpu H + K + -ATPase -. Toto působení na poslední fázi procesu tvorby žaludeční kyseliny je závislé na dávce a způsobuje vysoce účinnou inhibici sekrece kyseliny, a to bazální i stimulované, bez ohledu na použitý stimul.
Farmakodynamické účinky
Všechny pozorované farmakodynamické účinky jsou způsobeny aktivitou omeprazolu na sekreci kyseliny.
Účinky na sekreci žaludeční kyseliny
Intravenózní podání omeprazolu umožňuje na dávce závislou inhibici sekrece žaludeční kyseliny u lidí. Aby se okamžitě dosáhlo snížení intragastrické kyselosti podobné té, která se dosahuje při opakovaných perorálních dávkách 20 mg, podání první dávky 40 mg intravenózně. Tato dávka vede k okamžitému snížení kyselosti v žaludku, které se po 24 hodinách sníží v průměru o 90%, jak po injekci, tak po intravenózní infuzi.
Inhibice sekrece kyseliny souvisí s oblastí pod křivkou plazmatické koncentrace / času (AUC) omeprazolu, ale ne se skutečnou plazmatickou koncentrací v daném čase.
Během léčby omeprazolem nebyla pozorována žádná tachyfylaxe.
Účinky na H. pylori
H. pylori je spojena s kyselinou peptickou, která zahrnuje vředovou chorobu dvanáctníku a vředovou chorobu žaludku. H. pylori je považován za hlavního viníka rozvoje gastritidy. H. pylori spolu se sekrecí žaludeční kyseliny představují nejdůležitější faktory pro rozvoj vředové choroby. H. pylori je to hlavní faktor rozvoje atrofické gastritidy, který je spojen se zvýšeným rizikem vzniku žaludečních nádorů.
Vymýcení H. pylori s omeprazolem a antimikrobiálními látkami je spojena s „vysokou mírou jizev a dlouhodobou remisí peptických vředů.
Jiné účinky související s inhibicí kyseliny
Během dlouhodobé léčby bylo pozorováno zvýšení frekvence výskytu žaludečních žlázových cyst, které představují fyziologický důsledek výrazné inhibice sekrece kyseliny. Tyto formace jsou benigní a reverzibilní.
Snížená kyselost žaludku jakéhokoli původu, včetně té, která je způsobena inhibitory protonové pumpy, zvyšuje bakteriální zátěž žaludku normálně přítomnou v gastrointestinálním traktu.Léčba léky snižujícími kyselinu může způsobit mírně zvýšené riziko gastrointestinálních infekcí, například z Salmonella A Campylobacter.
05.2 Farmakokinetické vlastnosti
Rozdělení
Zdánlivý distribuční objem u zdravých subjektů je přibližně 0,3 l / kg tělesné hmotnosti.
97% omeprazolu se váže na plazmatické proteiny.
Metabolismus
Omeprazol je zcela metabolizován systémem cytochromu P450 (CYP). Většina jeho metabolismu je závislá na specifické polymorfně exprimované izoformě CYP2C19 odpovědné za tvorbu hydroxyomeprazolu, který je hlavním plazmatickým metabolitem. Zbytek závisí na jiné specifické izoformě, CYP3A4, zodpovědné za tvorbu sulfonu omeprazolu. V důsledku vysoké afinity omeprazolu k CYP2C19 existuje potenciál pro kompetitivní inhibici a metabolickou interakci léčivo-léčivo mezi omeprazolem a jinými substráty CYP2C19. Vzhledem ke své nízké afinitě k CYP3A4 však omeprazol nemá schopnost inhibovat metabolismus jiných substrátů CYP3A4.Omeprazol navíc nemá žádný inhibiční účinek na hlavní enzymy CYP.
Přibližně 3% kavkazské populace a 15–20% asijské populace mají funkční nedostatek enzymu CYP2C19, což je definováno jako pomalí metabolizátoři. U těchto jedinců je metabolismus omeprazolu pravděpodobně více katalyzován CYP3A4. Po opakovaném podání omeprazolu.20 mg omeprazolu jednou denně, průměrná AUC byla 5 až 10krát vyšší u pomalých metabolizátorů než u subjektů s funkčním enzymem CYP2C19 (extenzivní metabolizátoři). Maximální plazmatické koncentrace byly 3 až 5krát vyšší. Tyto výsledky nemají žádný vliv na dávkování omeprazolu.
Vylučování
Celková plazmatická clearance je po jedné dávce přibližně 30-40 l / h. Plazmatický poločas eliminace omeprazolu je obvykle méně než jednu hodinu po jednorázovém i opakovaném denním podávání.
Omeprazol je mezi dávkami zcela odstraněn z plazmy, a proto neexistuje tendence k akumulaci během podávání jednou denně. Přibližně 80% dávky omeprazolu se vylučuje močí jako metabolity, zbytek se nachází ve stolici pocházející primárně z biliární sekrece.
Po opakovaném podání se zvyšuje AUC omeprazolu. Toto zvýšení je závislé na dávce a vede k nelineárnímu vztahu dávka-AUC po opakovaném podání. Závislost na čase a dávce je způsobena snížením metabolismu prvního průchodu a systémové clearance. způsobené inhibicí enzymu CYP2C19 omeprazolem a / nebo jeho metabolity (např. sulfonem).
Nebyl pozorován žádný účinek metabolitů na sekreci žaludeční kyseliny.
Zvláštní populace
Zhoršená funkce jater
U pacientů s jaterní dysfunkcí je metabolismus omeprazolu narušen, což má za následek zvýšení AUC. Při podávání omeprazolu jednou denně nebyla tendence k akumulaci.
Porucha funkce ledvin
Farmakokinetika omeprazolu, včetně systémové biologické dostupnosti a rychlosti eliminace, se u pacientů s poruchou funkce ledvin nemění.
Senioři
Rychlost metabolismu omeprazolu je u starších subjektů (75-79 let) mírně snížena.
05.3 Předklinické údaje vztahující se k bezpečnosti
Hyperplazie žaludečních ECL buněk a karcinoidy byly detekovány ve studiích na potkanech léčených celoživotně omeprazolem. Tyto změny jsou důsledkem vysoké hypergastrinémie sekundární k inhibici kyseliny. Podobná pozorování byla získána po ošetření H2 antagonisty, inhibitory protonové pumpy a po částečné resekci fundusu. Tyto změny proto nelze přičíst přímému účinku žádné jednotlivé účinné látky.
06.0 FARMACEUTICKÉ INFORMACE
06.1 Pomocné látky
Edetát dvojsodný,
hydroxid sodný (pro úpravu pH).
06.2 Neslučitelnost
Tento léčivý přípravek nesmí být mísen s jinými léčivými přípravky kromě těch, které jsou uvedeny v bodě 6.6.
06.3 Doba platnosti
V neporušeném obalu: 2 roky.
Rekonstituovaný roztok:
Chemická a fyzikální stabilita byla prokázána po dobu 12 hodin při 25 ° C po rekonstituci infuzním roztokem chloridu sodného 9 mg / ml (0,9%) a po dobu 6 hodin při 25 ° C po rekonstituci infuzním roztokem glukózy. 50 mg / ml (5%).
Z mikrobiologického hlediska by měl být přípravek použit okamžitě, pokud rekonstituce neproběhla za kontrolovaných a validovaných aseptických podmínek.
06.4 Zvláštní opatření pro skladování
Uchovávejte při teplotě do 25 ° C.
Uchovávejte injekční lahvičku v původním obalu, aby byl přípravek chráněn před světlem. Lahvičky však lze skladovat po vybalení z krabice za normálních světelných podmínek vnitřního prostředí až 24 hodin.
Podmínky uchovávání rekonstituovaného léčivého přípravku viz bod 6.3.
06.5 Charakter vnitřního obalu a obsah balení
Injekční lahvička s 10 ml bezbarvého borosilikátového skla, typ I.Brombutylová gumová zátka, hliníkový uzávěr a polypropylenový uzávěr.
Velikosti balení: lahvičky 1x40 mg, 5x40 mg, 10x40 mg.
Na trhu nemusí být všechny velikosti balení.
06.6 Návod k použití a zacházení
Celý obsah každé lahvičky by měl být rozpuštěn přibližně v 5 ml a okamžitě zředěn ve 100 ml. Měl by být použit infuzní roztok chloridu sodného 9 mg / ml (0,9%) nebo infuzní roztok glukózy 50 mg / ml (5%) stabilita omeprazolu je ovlivněna pH infuzního roztoku, proto je třeba se vyvarovat použití jiných rozpouštědel nebo objemů k ředění.
Příprava
1. Natáhněte 5 ml infuzního roztoku z lahve nebo 100 ml infuzního vaku pomocí injekční stříkačky.
2. Přeneste toto množství do lahvičky obsahující lyofilizovaný omeprazol, dobře protřepejte a ujistěte se, že je omeprazol zcela rozpuštěn.
3. Natáhněte výsledný roztok omeprazolu injekční stříkačkou.
4. Přeneste roztok do infuzního vaku nebo lahve.
5. Opakujte kroky 1-4, abyste zajistili, že veškeré množství omeprazolu bude přeneseno z lahvičky do infuzního vaku nebo lahve.
Alternativní infuzní přípravky v pružných nádobách
1. Použijte přenosovou jehlu s oboustranným koncem a připevněte ji k injekční membráně infuzního vaku. Připojte druhý konec jehly k injekční lahvičce obsahující lyofilizovaný omeprazol.
2. Omeprazol rozpusťte pumpováním infuzního roztoku mezi infuzní vak a láhev.
3. Ujistěte se, že je omeprazol zcela rozpuštěn.
Infuzní roztok by měl být podáván jako intravenózní infuze trvající 20-30 minut.
Nepoužitý léčivý přípravek nebo odpad z tohoto přípravku musí být zlikvidován v souladu s místními předpisy.
07.0 DRŽITEL ROZHODNUTÍ O REGISTRACI
Bracco S.p.A.
Via E. Folli, 50 Milán (MI)
pod licencí AstraZeneca AB - Švédsko
08.0 REGISTRAČNÍ ČÍSLO
MEPRAL 40 mg prášek pro infuzní roztok 1 injekční lahvička po 40 mg: AIC č. 026783023.
MEPRAL 40 mg prášek pro infuzní roztok 5 injekčních lahviček po 40 mg: AIC č. 026783035.
09.0 DATUM PRVNÍ REGISTRACE NEBO PRODLOUŽENÍ REGISTRACE
Datum první registrace: květen 1996
Datum posledního prodloužení: leden 2008
10.0 DATUM REVIZE TEXTU
Prosinec 2012