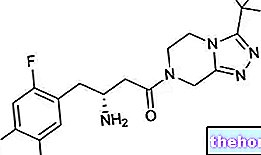
Co je Lojuxta - lomitapid a k čemu se používá?
Lojuxta je léčivý přípravek, který obsahuje léčivou látku lomitapid, který se používá k léčbě dospělých pacientů s homozygotní familiární hypercholesterolemií, dědičným onemocněním, které způsobuje zvýšení hladiny cholesterolu v krvi (druh tuku). Tento léčivý přípravek se používá společně s dietou s nízkým obsahem tuků a dalšími léky ke snížení hladiny tuků v krvi. Pokud je to možné, nemoc pacienta by měla být diagnostikována genetickým testováním.
Jak se přípravek Lojuxta používá - lomitapid?
Výdej přípravku Lojuxta je vázán na lékařský předpis. Je k dispozici ve formě tobolek (5, 10 a 20 mg), které se užívají ústy na prázdný žaludek, nejméně dvě hodiny po večeři. Terapii by měl zahájit a sledovat lékař se zkušenostmi s léčbou stavů vedoucích ke zvýšení hladiny tuků v krvi. Léčba by měla začít dávkou 5 mg jednou denně; pokud je dobře snášen, lze dávku postupně zvyšovat až na maximální dávku 60 mg. Pacienti s poruchou funkce jater nebo pacienti na dialýze ledvin a ti, kteří užívají některé další léky, budou muset užívat sníženou dávku. Další informace naleznete v příbalové informaci.
Jak přípravek Lojuxta - lomitapide působí?
Účinná látka v přípravku Lojuxta, lomitapid, blokuje v těle působení látky zvané „mikrosomální protein pro přenos triglyceridů“, která se nachází v jaterních buňkách a střevech. Tato látka je zodpovědná za akumulaci látek. Tuku, jako je cholesterol a triglyceridy ve větších částicích nazývané lipoproteiny, které se následně uvolňují do krve. Blokováním tohoto proteinu snižuje Lojuxta hladinu tuků uvolňovaných do krve, čímž pomáhá snižovat hladinu cholesterolu při hypercholesterolemii.
Jaký přínos přípravku Lojuxta - lomitapide byl prokázán v průběhu studií?
Přínosy přípravku Lojuxta při snižování hladiny cholesterolu v krvi byly hodnoceny v hlavní studii zahrnující 29 pacientů s homozygotní familiární hypercholesterolemií. Všichni pacienti byli léčeni přípravkem Lojuxta v kombinaci s jinými léky snižujícími tuky v krvi. Lojuxta nebyla srovnávána s jinými terapiemi. Hlavní měřítkem účinnosti byly změny hladin lipoproteinů s nízkou hustotou v krvi (LDL), běžně známých jako „špatný cholesterol“, u pacientů 26 týdnů po léčbě. V průměru byla hladina LDL cholesterolu pacientů snížena o 40%.
Jaká rizika jsou spojena s přípravkem Lojuxta - lomitapide?
Nejzávažnějším nežádoucím účinkem pozorovaným u některých pacientů léčených přípravkem Lojuxta je abnormální zvýšení hladin enzymů v játrech.Nejčastějšími vedlejšími účinky jsou střevní potíže, které mohou postihnout až 9 z 10 lidí: průjem, nevolnost, dyspepsie (pálení žáhy, žaludek) ) a zvracení byly pozorovány u více než 3 z 10 lidí, přičemž nejméně 2 z 10 lidí uvedlo bolest břicha, nepohodlí a nadýmání, zácpu a plynatost. Úplný seznam nežádoucích účinků hlášených u přípravku Lojuxta je uveden v příbalové informaci. Lojuxta by neměla být používána těhotnými ženami. Nesmí být také používán u pacientů se středně těžkou až těžkou poruchou funkce jater nebo s abnormálními a nevysvětlenými výsledky jaterních testů nebo u osob s významnými nebo dlouhodobými střevními potížemi. Lojuxta by neměla být používána současně s dávkou simvastatinu (jiného léku používaného ke snížení hladiny cholesterolu v krvi) vyšší než 40 mg nebo s některými jinými léky, které ovlivňují rozklad lomitapidu v těle. Jejich úplný seznam omezení viz. příbalový leták.
Na základě čeho byl přípravek Lojuxta - lomitapide schválen?
Výbor agentury pro humánní léčivé přípravky (CHMP) rozhodl, že přínosy přípravku Lojuxta převyšují jeho rizika, a proto doporučil, aby byl schválen k použití v EU. pokud jde o snižování hladin LDL cholesterolu. Výbor CHMP však poznamenal, že dlouhodobý přínos pro kardiovaskulární systém musí být ještě potvrzen. Výbor rovněž poznamenal, že přípravek Lojuxta má u většiny pacientů ve střevě vedlejší účinky, někdy takového rozsahu že je nutné přerušit léčbu a že tento lék vedl ke zvýšení hladin enzymů v játrech, jejichž dlouhodobé důsledky nejsou známy. Výbor proto stanovil, že tyto účinky je třeba pečlivě sledovat a řídit. Lojuxta byla registrována za „výjimečných okolností“, protože kvůli vzácnosti onemocnění nebylo možné získat úplné informace o přípravku Lojuxta. Evropská agentura pro léčivé přípravky každý rok posoudí dostupné nové informace a tento souhrn bude odpovídajícím způsobem aktualizován.
Jaké informace o přípravku Lojuxta - lomitapide stále čekají?
Jelikož byl přípravek Lojuxta za výjimečných okolností registrován, provede společnost, která tento léčivý přípravek uvádí na trh, dlouhodobou studii u pacientů léčených přípravkem Lojuxta, aby poskytla další údaje o jeho bezpečnosti a účinnosti, včetně vedlejších účinků na játra, žaludek, střeva a kardiovaskulární systém. Studie také poskytne údaje o těhotenství žen užívajících tento lék a o tom, jak zdravotníci dodržují doporučení pro screening a sledování pacientů před a během léčby.
Jaká opatření jsou přijímána k zajištění bezpečného a účinného používání přípravku Lojuxta - lomitapide?
Aby byl přípravek Lojuxta používán co nejbezpečněji, byl vypracován plán řízení rizik. Na základě tohoto plánu byly do souhrnu údajů o přípravku a příbalové informace přípravku Lojuxta přidány informace o bezpečnosti, včetně příslušných opatření, která by měli zdravotničtí pracovníci a pacienti dodržovat. Kromě toho společnost, která uvádí na trh přípravek Lojuxta, poskytne všem lékařům, kteří mohou přípravek Lojuxta předepisovat, vzdělávací materiály obsahující pokyny k výběru vhodných pacientů a také základní informace o bezpečnosti, včetně vedlejších účinků, interakcí s jinými léky a použití u starších žen. být rovněž poskytnuty k distribuci pacientům, včetně letáku a výstražné karty.
Více informací o Lojuxta - lomitapide
Dne 31. července 2013 udělila Evropská komise pro přípravek Lojuxta „Registraci“ platnou v celé Evropské unii. Další informace o léčbě přípravkem Lojuxta naleznete v příbalové informaci (součástí zprávy EPAR) nebo se poraďte se svým lékařem nebo lékárníkem. Poslední aktualizace tohoto souhrnu: 08-2013
Informace o Lojuxta - lomitapide zveřejněné na této stránce mohou být zastaralé nebo neúplné. Správné použití těchto informací najdete na stránce Prohlášení a užitečné informace.