Aktivní složky: Ranolazin
Ranexa 375 mg tablety s prodlouženým uvolňováním
Ranexa 500 mg tablety s prodlouženým uvolňováním
Ranexa 750 mg tablety s prodlouženým uvolňováním
Proč se používá Ranexa? K čemu to je?
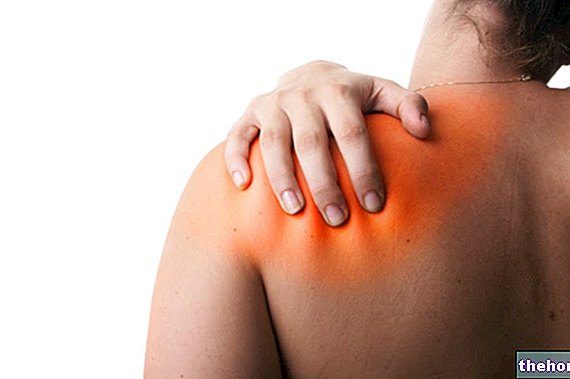
Ranexa je léčivý přípravek používaný v kombinaci s jinými léky k léčbě anginy pectoris, poruchy, která se vyskytuje s bolestí nebo nepříjemným pocitem na hrudi lokalizovaným kdekoli v horní části trupu mezi krkem a horní částí břicha, často vyvolaná cvičením. fyzická nebo nadměrná „aktivita“.
Promluvte si se svým lékařem, pokud se necítíte lépe nebo se cítíte hůř.
Kontraindikace Kdy by Ranexa neměla být použita
Neužívejte Ranexu
- jestliže jste alergický (á) na ranolazin nebo na kteroukoli další složku tohoto přípravku
- jestliže máte závažné problémy s ledvinami.
- jestliže máte středně závažné nebo závažné problémy s játry.
- pokud používáte určité léky k léčbě bakteriálních infekcí (klarithromycin, telithromycin), mykotických infekcí (itrakonazol, ketokonazol, vorikonazol, posakonazol), infekce HIV (inhibitory proteáz), deprese (nefazodon) nebo poruch srdečního rytmu (např. chinidin, dofetilid nebo sotalol ).
Opatření pro použití Co potřebujete vědět před užitím přípravku Ranexa
Před užitím přípravku Ranexa se poraďte se svým lékařem:
- jestliže máte mírné nebo středně závažné problémy s ledvinami.
- jestliže máte mírné problémy s játry.
- jestliže jste někdy měl (a) abnormální elektrokardiogram (EKG).
- jestliže jste starší.
- pokud vážíte málo (60 kg nebo méně).
- pokud máte srdeční selhání. V těchto případech se lékař může rozhodnout, že vám podá nižší dávku nebo učiní jiná opatření.
Interakce Které léky nebo potraviny mohou změnit účinek přípravku Ranexa
Pokud užíváte přípravek Ranexa, neužívejte následující léky:
- některé léky k léčbě bakteriálních infekcí (klarithromycin, telithromycin), houbových infekcí (itrakonazol, ketokonazol, vorikonazol, posakonazol), infekce HIV (inhibitory proteáz), deprese (nefazodon) nebo srdečních poruch (např. chinidin, dofetilid nebo sotalol).
Před užitím přípravku Ranexa informujte svého lékaře nebo lékárníka, pokud používáte:
- některé léky k léčbě „bakteriální infekce (erythromycin) nebo“ houbové infekce (flukonazol), lék používaný k zabránění odmítnutí transplantovaného orgánu (cyklosporin), nebo pokud užíváte srdeční tablety, jako je diltiazem nebo verapamil. Tyto léky mohou zvýšit počet nežádoucích účinků, jako jsou závratě, nevolnost nebo zvracení, což jsou možné vedlejší účinky přípravku Ranexa. Váš lékař se může rozhodnout předepsat sníženou dávku.
- léky k léčbě epilepsie nebo jiné neurologické poruchy (např. fenytoin, karbamazepin nebo fenobarbital); pokud užíváte rifampicin na „infekci (např. tuberkulózu) nebo bylinný přípravek„ třezalka tečkovaná “, protože tyto léky mohou snižovat účinnost přípravku Ranexa .
- léky na srdce obsahující digoxin nebo metoprolol, protože váš lékař může rozhodnout o změně dávky těchto léků během užívání přípravku Ranexa.
- některé léky k léčbě alergií (např. terfenadin, astemizol, mizolastin), poruchy srdečního rytmu (např. disopyramid, prokainamid) a deprese (např. „imipramin, doxepin nebo“ amitriptylin), protože tyto léky mohou měnit EKG.
- některé léky k léčbě deprese (bupropion), psychózy, infekce HIV (efavirenz) nebo rakoviny (cyklofosfamid).
- některé léky k léčbě vysokých hladin cholesterolu v krvi (např. simvastatin, lovastatin, atorvastatin). Tyto léky mohou způsobit bolest a poškození svalů. Váš lékař se může rozhodnout změnit dávku těchto léků během užívání přípravku Ranexa.
- některé léky používané k prevenci odmítnutí transplantovaného orgánu (např. takrolimus, cyklosporin, sirolimus, everolimus), protože váš lékař může rozhodnout o změně dávky těchto léků během užívání přípravku Ranexa.
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval (a) nebo které možná budete užívat.
Ranexa s jídlem a pitím
Přípravek Ranexa lze užívat s jídlem nebo bez jídla. Během léčby přípravkem Ranexa byste neměli pít grapefruitový džus.
Varování Je důležité vědět, že:
Těhotenství
Pokud jste těhotná, neužívejte Ranexu, pokud jste těhotná.
Čas krmení
Neužívejte Ranexu, pokud kojíte. Pokud kojíte, požádejte o radu svého lékaře. Pokud jste těhotná, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem dříve, než začnete tento přípravek užívat.
Řízení dopravních prostředků a obsluha strojů
Nebyly provedeny žádné studie účinků přípravku Ranexa na schopnost řídit a obsluhovat stroje. Požádejte svého lékaře o radu ohledně řízení a obsluhy strojů.
Přípravek Ranexa může způsobit nežádoucí účinky, jako jsou závratě (časté), rozmazané vidění (méně časté), zmatenost (méně časté), halucinace (méně časté), dvojité vidění (méně časté), abnormální koordinace (vzácné), které by mohly ovlivnit vaši schopnost řídit nebo obsluhovat stroje . Pokud se u vás tyto příznaky objeví, neřiďte ani neobsluhujte stroje, dokud se zcela nevyřeší.
Ranexa 750 mg tablety s prodlouženým uvolňováním obsahují azobarvivou látku E102. Tato barvicí látka může vyvolat alergické reakce.
Ranexa 750 mg tablety s prodlouženým uvolňováním obsahují monohydrát laktosy. Pokud vám lékař řekl, že trpíte „nesnášenlivostí k některému druhu cukru, kontaktujte svého lékaře před užitím tohoto léku.
Dávka, způsob a doba podání Jak používat Ranexu: Dávkování
Vždy užívejte tento přípravek přesně podle pokynů svého lékaře. V případě pochybností se poraďte se svým lékařem nebo lékárníkem.
Tablety by se měly vždy polykat celé a zapíjet vodou. Tablety byste neměli drtit, sát nebo žvýkat ani je dělit na poloviny, protože to může ovlivnit způsob uvolňování léčiva z tablety do vašeho těla.
Počáteční dávka u dospělých je jedna 375 mg tableta dvakrát denně. Po 2-4 týdnech může lékař dávku zvýšit, aby dosáhl požadovaného účinku. Maximální dávka přípravku Ranexa je 750 mg dvakrát denně.
Je důležité, abyste informoval (a) svého lékaře, pokud se u Vás vyskytnou nežádoucí účinky, jako jsou závratě, nevolnost nebo zvracení. Lékař vám může snížit dávku, nebo pokud to nestačí, ukončete léčbu přípravkem Ranexa.
Použití u dětí a dospívajících
Děti a mladiství do 18 let by neměli přípravek Ranexa užívat.
Předávkování Co dělat, když jste užil příliš mnoho přípravku Ranexa
Jestliže jste užil (a) více přípravku Ranexa, než jste měl (a)
Pokud omylem užijete příliš mnoho tablet přípravku Ranexa nebo užijete vyšší dávku, než doporučil lékař, je důležité, abyste jim to ihned sdělil. Pokud se nemůžete spojit se svým lékařem, navštivte nejbližší pohotovost. Vezměte si s sebou všechny zbývající tablety, včetně obalu a krabičky, aby nemocniční personál snadno porozuměl tomu, co užíváte.
Pokud zapomenete užít Ranexu
Pokud zapomenete užít dávku, vezměte si ji, jakmile si vzpomenete, pokud již není téměř čas na další dávku (pokud zbývá méně než 6 hodin). Nezdvojnásobujte následující dávku, abyste nahradil (a) vynechanou dávku.
Nežádoucí účinky Jaké jsou vedlejší účinky přípravku Ranexa
Podobně jako všechny léky, může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Pokud se u vás objeví následující příznaky angioneurotického edému, což je vzácný, ale někdy závažný stav, měli byste přestat užívat přípravek Ranexa a okamžitě navštívit svého lékaře:
- otok obličeje, jazyka nebo hrdla
- potíže s polykáním
- kopřivka nebo potíže s dýcháním.
Informujte svého lékaře, pokud se u vás vyskytnou běžné nežádoucí účinky, jako jsou závratě, nevolnost nebo zvracení. Lékař vám může snížit dávku nebo ukončit léčbu přípravkem Ranexa.
Mezi další nežádoucí účinky, které můžete zaznamenat, patří:
Časté nežádoucí účinky (postihují 1 až 10 uživatelů ze 100):
zácpa
závrať
bolest hlavy
nevolnost,
Zvracel
pocit slabosti.
Méně časté nežádoucí účinky (postihují 1 až 10 uživatelů z 1000):
zhoršená citlivost
úzkost, potíže se spánkem, zmatenost, halucinace
rozmazané vidění, poruchy vidění, změny ve smyslech (dotyku nebo chuti), třes, pocit únavy nebo malátnosti, necitlivost nebo ospalost, pocit na omdlení nebo mdloby, závratě při vstávání
tmavá moč, krev v moči, potíže s močením
dehydratace
potíže s dýcháním, kašel, krvácení z nosu
dvojité vidění
nadměrné pocení, svědění
pocit otoku nebo plnosti
návaly horka, nízký krevní tlak
zvyšuje se látka nazývaná kreatinin nebo se zvyšuje hladina močoviny v krvi, počet krevních destiček nebo bílých krvinek v krvi, změny srdeční EKG stopy
otok kloubů, bolest v končetinách
ztráta chuti k jídlu a / nebo ztráta hmotnosti
svalové křeče
pocit zvonění v uších a / nebo závratě
bolest nebo nepohodlí v žaludku, poruchy trávení, sucho v ústech nebo střevní vzduch.
Vzácné nežádoucí účinky (postihují 1 až 10 uživatelů z 10 000):
potíže s normálním močením
změněné laboratorní hodnoty pro játra
akutní selhání ledvin
změněný čich, necitlivost úst nebo rtů, zhoršený sluch
studený pot, vyrážka
problémy s koordinací
pokles krevního tlaku při vstávání, pokles nebo ztráta vědomí
dezorientace
pocit chladu v rukou a nohou, kopřivka, alergická kožní reakce
impotence
potíže s chůzí kvůli nedostatku rovnováhy
zánět slinivky břišní nebo střev
ztráta paměti
sevření v krku.
Byl hlášen také následující nežádoucí účinek: Svalová slabost
Hlášení nežádoucích účinků
Pokud se u vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
Expirace a retence
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti, uvedené na každém blistru tablet a na vnější straně krabičky a lahvičky za „EXP“.
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Pomůže to chránit životní prostředí.
Co přípravek Ranexa obsahuje
Účinnou látkou přípravku Ranexa je ranolazin. Jedna tableta obsahuje ranolazinum 375 mg, 500 mg nebo 750 mg.
Dalšími složkami jsou: hypromelóza, stearát hořečnatý, kopolymer ethylakrylátu a kyseliny methakrylové, mikrokrystalická celulóza, hydroxid sodný, oxid titaničitý a karnaubský vosk.
V závislosti na síle tablety obsahuje povlak také:
375 mg tableta: makrogol, polysorbát 80, modrý č. 2 / E132 hlinitý lak indigokarmínu
500 mg tableta: makrogol, mastek, částečně hydrolyzovaný polyvinylalkohol, žlutý oxid železitý (E172), červený oxid železitý (E172)
750 mg tableta: glycerol triacetát, monohydrát laktózy, modrá č. 1 / E133 jasně modrý hliníkový lak FCF a žlutá č. 5 / E102 tartrazinový hlinitý lak
Jak Ranexa vypadá a obsah balení
Tablety Ranexa s prodlouženým uvolňováním jsou oválné tablety.
375 mg tablety jsou světle modré s vyraženým 375 na jedné straně.
500mg tablety jsou světle oranžové a s vyraženým 500 na jedné straně.
750 mg tablety jsou světle zelené a s vyraženým 750 na jedné straně.
Ranexa se dodává v krabičkách po 30, 60 nebo 100 tabletách obsažených v blistrech nebo 60 tabletách v lahvičce. Na trhu nemusí být všechny velikosti balení.
Zdroj příbalové informace: AIFA (Italská agentura pro léčivé přípravky). Obsah zveřejněný v lednu 2016. Přítomné informace nemusí být aktuální.
Abyste měli přístup k nejaktuálnější verzi, doporučujeme navštívit webovou stránku AIFA (Italská agentura pro léčivé přípravky). Prohlášení a užitečné informace.
01.0 NÁZEV LÉČIVÉHO PŘÍPRAVKU
RANEXA 375 MG ROZŠÍŘENÉ TABLETY PRO UVOLNĚNÍ
02.0 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna tableta obsahuje ranolazinum 375 mg.
Úplný seznam pomocných látek viz bod 6.1.
03.0 LÉKOVÁ FORMA
Tablet s prodlouženým uvolňováním
Světle modrá oválná tableta s vyraženým CVT375 nebo 375 na jedné straně.
04.0 KLINICKÉ INFORMACE
04.1 Terapeutické indikace
Přípravek Ranexa je indikován u dospělých jako doplňková terapie u symptomatické léčby pacientů se stabilní anginou pectoris, kteří nejsou adekvátně kontrolováni nebo netolerují antianginózní terapie první linie, jako jsou beta-blokátory a / nebo blokátory kalciových kanálů.
04.2 Dávkování a způsob podání
Pacienti by měli dostat příbalovou informaci Ranexa a bezpečnostní kartu pacienta s varováním, aby ji při každé návštěvě předložili zdravotnickému pracovníkovi spolu se seznamem léků.
Dávkování
Ranexa je k dispozici jako 375 mg, 500 mg a 750 mg tablety s prodlouženým uvolňováním.
Dospělí
Doporučená počáteční dávka přípravku Ranexa je 375 mg dvakrát denně. Po 2-4 týdnech by měla být dávka zvýšena na 500 mg dvakrát denně a na základě odpovědi pacienta dále zvýšena na maximální doporučenou dávku 750 mg dvakrát denně (viz bod 5.1).
Pokud se u pacienta vyskytnou nežádoucí účinky související s léčbou, jako jsou závratě, nevolnost nebo zvracení, může být nutné dávku přípravku Ranexa snížit na 500 mg nebo 375 mg dvakrát denně. Pokud příznaky po snížení dávky nevymizí, léčba by měla být přerušena.
Souběžná léčba s inhibitory CYP3A4 a P-glykoproteinem (P-gp)
U pacientů léčených středně silnými inhibitory CYP3A4 (např. Diltiazem, flukonazol, erythromycin) nebo inhibitory P-gp (např. Verapamil, cyklosporin) se doporučuje opatrná úprava dávky (viz body 4.4 a 4.5).
Současné podávání silných inhibitorů CYP3A4 je kontraindikováno (viz body 4.3 a 4.5).
Selhání ledvin
U pacientů s lehkou nebo středně těžkou poruchou funkce ledvin (clearance kreatininu 30-80 ml / min) se doporučuje opatrná úprava dávky (viz body 4.4, 4.8 a 5.2). Přípravek Ranexa je kontraindikován u pacientů s těžkou renální insuficiencí (clearance kreatininu
Jaterní nedostatečnost
U pacientů s mírnou poruchou funkce jater se doporučuje opatrná úprava dávky (viz body 4.4 a 5.2). Ranexa je kontraindikován u pacientů se středně těžkou nebo těžkou poruchou funkce jater (viz body 4.3 a 5.2).
Senioři
Opatrnosti je třeba při úpravě dávky u starších pacientů (viz bod 4.4). Expozice ranolazinu se u starších osob může zvyšovat v důsledku poklesu funkce ledvin souvisejícího s věkem (viz bod 5.2). Výskyt nežádoucích účinků byl u starších osob vyšší ( viz bod 4.8).
Pacienti s podváhou
Výskyt nežádoucích účinků byl vyšší u pacientů s podváhou (≤ 60 kg) .U pacientů s podváhou je třeba postupovat opatrně při úpravě dávky (viz body 4.4, 4.8 a 5.2).
Městnavé srdeční selhání (SCC)
Opatrnosti je třeba při úpravě dávky u pacientů se středně závažným nebo závažným SCC (třída NYHA III-IV) (viz body 4.4 a 5.2).
Pediatrická populace
Bezpečnost a účinnost přípravku Ranexa u dětí mladších 18 let nebyla stanovena.
Nejsou k dispozici žádné údaje.
Způsob podání
Tablety přípravku Ranexa se polykají celé, bez drcení, lámání nebo žvýkání. Mohou být užívány s jídlem nebo bez jídla.
04.3 Kontraindikace
Přecitlivělost na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
Těžká renální insuficience (clearance kreatininu
Středně těžká nebo těžká porucha funkce jater (viz body 4.2 a 5.2).
Současné podávání silných inhibitorů CYP3A4 (např. Itrakonazolu, ketokonazolu, vorikonazolu, posakonazolu, inhibitorů HIV proteázy, klarithromycinu, telithromycinu, nefazodonu) (viz body 4.2 a 4.5).
Současné podávání antiarytmik třídy Ia (např. Chinidin) nebo třídy III (např. Dofetilid, sotalol) jiných než amiodaron.
04.4 Zvláštní upozornění a vhodná opatření pro použití
Při předepisování nebo zvyšování dávky ranolazinu u pacientů, u nichž se „předpokládá vyšší expozice:“, je nutná opatrnost.
• souběžné podávání středně silných inhibitorů CYP3A4 (viz body 4.2 a 4.5)
• souběžné podávání inhibitorů P-gp (viz body 4.2 a 4.5)
• mírná jaterní insuficience (viz body 4.2 a 5.2)
• mírná nebo středně těžká renální insuficience (clearance kreatininu 30–80 ml / min) (viz body 4.2, 4.8 a 5.2).
• starší pacienti (viz body 4.2, 4.8 a 5.2)
• pacienti s podváhou (≤ 60 kg) (viz body 4.2, 4.8 a 5.2).
• pacienti se středně těžkým nebo těžkým SCC (NYHA třída III-IV) (viz body 4.2 a 5.2).
U pacientů s více než jedním z výše uvedených faktorů se očekává další zvýšení expozice.Je pravděpodobné, že se vyskytnou vedlejší účinky závislé na dávce. Pokud je přípravek Ranexa používán u pacientů, kteří mají kombinaci několika výše uvedených faktorů, je nutné časté sledování nežádoucích účinků, snížení dávky a v případě potřeby přerušení léčby.
Riziko zvýšené expozice vedoucí k nežádoucím účinkům v těchto různých podskupinách je vyšší u pacientů se slabou aktivitou CYP2D6 (pomalí metabolizátoři, ML) než u subjektů s dobrými metabolizátory CYP2D6 (extenzivní metabolizátoři, MR). (Viz bod 5.2). jsou založeny na riziku hlášeném pacientovi s CYP2D6 ML a jsou vyžadovány, pokud není znám stav CYP2D6. U pacientů s podmínkami CYP2D6 MR jsou tato opatření méně nutná. Pacient s CYP2D6 byl stanoven například genotypizací nebo je již znám jako MR Přípravek Ranexa lze s opatrností používat u pacientů s kombinací několika výše uvedených rizikových faktorů.
Prodloužení QT
„Populační analýza souhrnných údajů od pacientů a zdravých dobrovolníků ukázala, že křivkový odhad poměru plazmatické koncentrace k QTc byl 2,4 msec na 1 000 ng / ml, což je zhruba stejné zvýšení o 2,7 m s pro rozsah plazmatických koncentrací což odpovídá 500–1 000 mg ranolazinu dvakrát denně.Proto je třeba postupovat opatrně při léčbě pacientů s osobní nebo rodinnou anamnézou vrozeného syndromu dlouhého QT, pacientů se získaným prodloužením QT intervalu a pacientů léčených léky, které ovlivňují QTc interval (viz také bod 4.5).
Interakce mezi léky
Při současném podávání s induktory CYP3A4 se očekává špatná účinnost. Ranexa by neměla být používána u pacientů léčených induktory CYP3A4 (např. Rifampicin, fenytoin, fenobarbital, karbamazepin, třezalka tečkovaná) (viz bod 4.5).
Selhání ledvin
Renální funkce klesá s věkem, a proto je důležité během léčby ranolazinem sledovat renální funkce v pravidelných intervalech (viz body 4.2, 4.3, 4.8 a 5.2).
04.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Účinky jiných léčivých přípravků na ranolazin
Inhibitory CYP3A4 nebo P-gp
Ranolazin je substrátem cytochromu CYP3A4. Inhibitory CYP3A4 zvyšují plazmatické koncentrace ranolazinu. Jak se plazmatické koncentrace zvyšují, může se také zvyšovat riziko nežádoucích účinků závislých na dávce (např. Nevolnost, závratě) Souběžná léčba 200 mg ketokonazolu dvakrát denně během léčby zvýšila AUC ranolazinu 3,0–3,9krát. Kombinace ranolazinu se silnými inhibitory CYP3A4 (např. Itrakonazol, ketokonazol, vorikonazol, posakonazol, inhibitory HIV proteázy, klarithromycin, telithromycin, nefazodon) je kontraindikována (viz bod 4.3). Grapefruitová šťáva je také silným inhibitorem CYP3A4.
Diltiazem, středně účinný inhibitor CYP3A4, v dávkách v rozmezí od 180 do 360 mg jednou denně způsobuje na dávce závislé zvýšení průměrných koncentrací ranolazinu v ustáleném stavu 1,5 až 2,4krát. U pacientů léčených diltiazemem a jinými středně silnými inhibitory CYP3A4, jako je erythromycin nebo flukonazol, se doporučuje pečlivá úprava dávky přípravku Ranexa. Dávku přípravku Ranexa bude možná nutné snížit (viz body 4.2 a 4.4).
Ranolazin je substrátem pro P-gp. Inhibitory P-gp, jako je cyklosporin nebo verapamil, zvyšují plazmatické hladiny ranolazinu. Verapamil v dávce 120 mg třikrát denně zvyšuje koncentrace ranolazinu v ustáleném stavu 2,2krát. U pacientů léčených inhibitory P-gp se doporučuje pečlivá úprava dávky přípravku Ranexa. Dávku přípravku Ranexa bude možná nutné snížit (viz body 4.2 a 4.4).
Induktory CYP3A4
Rifampicin v dávce 600 mg jednou denně snižuje koncentrace ranolazinu v ustáleném stavu přibližně o 95%. Během podávání induktorů CYP3A4 (např. Rifampicin, fenytoin, fenobarbital, karbamazepin, třezalka tečkovaná) je třeba se léčbě přípravkem Ranexa vyvarovat (viz bod 4.4).
Inhibitory CYP2D6
Ranolazin je částečně metabolizován CYP2D6, takže inhibitory tohoto enzymu mohou zvýšit plazmatické koncentrace léčiva. Paroxetin, silný inhibitor CYP2D6, v dávce 20 mg jednou denně zvýšil v ustáleném stavu plazmatické koncentrace ranolazinu v dávce 1 000 mg dvakrát denně v průměru 1,2násobně. Nejsou nutné žádné úpravy dávkování. Při dávce 500 mg dvakrát denně by souběžné podávání silného inhibitoru CYP2D6 mohlo vést ke zvýšení AUC ranolazinu přibližně o 62%.
Účinky ranolazinu na jiné léčivé přípravky
Ranolazin je středně silný / silný inhibitor P-gp a mírný inhibitor CYP3A4 a může zvýšit plazmatické koncentrace substrátů P-gp nebo CYP3A4. Tkáňovou distribuci léčiv nesených P-gp lze zvýšit.
Může být vyžadována úprava dávky substrátů citlivých na CYP3A4 (např. Simvasastatin, lovastatin) a substrátů citlivých na CYP3A4 s úzkým terapeutickým indexem (např. Cyklosporin, takrolimus, sirolimus, everolimus), protože RANEXA může zvýšit plazmatickou koncentraci těchto léčiv.
Na základě dostupných údajů se zdá, že ranolazin je mírným inhibitorem CYP2D6. Ranexa 750 mg dvakrát denně zvyšuje plazmatické koncentrace metoprololu 1,8krát. Proto může být expozice metoprololu nebo jiným substrátům CYP2D6 (např. Propafenonu a flekainidu nebo v menší míře tricyklických antidepresiv a antipsychotik) při souběžném podávání s přípravkem Ranexa zvýšena a mohou být vyžadovány nižší dávky těchto léčivých přípravků.
Inhibiční kapacita CYP2B6 nebyla hodnocena. Při současném podávání se substráty CYP2B6 (např. Bupropion, efavirenz, cyklofosfamid) se doporučuje opatrnost.
Digoxin
Po souběžném podávání přípravku Ranexa a digoxinu bylo hlášeno průměrné 1,5násobné zvýšení plazmatických koncentrací digoxinu. Po zahájení a ukončení léčby přípravkem Ranexa je proto nutné monitorování hladin digoxinu.
Simvastatin
Metabolismus a clearance simvastatinu jsou vysoce závislé na CYP3A4. Ranexa 1 000 mg dvakrát denně zvýšila plazmatické koncentrace simvastatinu jako laktonu a kyseliny přibližně dvojnásobně. Rabdomyolýza byla spojena s vysokými dávkami simvastatinu a po uvedení přípravku na trh byly u pacientů užívajících Ranexu a simvastatin pozorovány případy rhabdomyolýzy. U pacientů užívajících Ranexu v jakékoli dávce omezte dávku simvastatinu na 20 mg jednou denně.
Atorvastatin
Ranexa 1 000 mg dvakrát denně zvýšila Cmax a AUC atorvastatinu 80 mg jednou denně 1,4krát a 1,3krát, a změnila Cmax a AUC metabolitů atorvastatinu o méně než 35%. V případě souběžného podávání přípravku Ranexa se doporučuje omezit dávku atorvastatinu a provést vhodné klinické sledování.
V případě souběžného podávání přípravku Ranexa se doporučuje omezit dávku jiných statinů metabolizovaných CYP3A4 (např. Lovastatin).
Takrolimus, cyklosporin, sirolimus, everolimus
Po podání ranolazinu byly u pacientů pozorovány zvýšené plazmatické koncentrace takrolimu, substrátu CYP3A4. Během souběžného podávání přípravku Ranexa a takrolimu se doporučuje sledovat hladiny takrolimu v krvi a podle toho upravit dávku takrolimu. To se také doporučuje v případě jiných substrátů CYP3A4 s úzkým terapeutickým indexem (např. Cyklosporin, sirolimus, everolimus).
Léky transportované OCT2 (transportér organických kationtů-2): plazmatická expozice metforminu (1 000 mg dvakrát denně) se zvýšila 1,4krát a 1,8krát u subjektů s diabetes mellitus 2. typu v případě souběžného podávání přípravku RANEXA 500 mg a 1000 mg dvakrát denně, resp. Expozice jiných substrátů OCT2 - např. Pindololu a vareniklinu - může být ovlivněna v podobné míře.
Existuje teoretické riziko, že souběžná léčba ranolazinem a jinými léky, které prodlužují QTc interval, vyvolá farmakodynamickou interakci, což zvyšuje riziko možných komorových arytmií. Mezi tyto léky patří některá antihistaminika, jako je terfenadin, astemizol nebo mizolastin, některá antiarytmika, jako je chinidin, disopyramid nebo prokainamid, erytromycin a tricyklická antidepresiva, jako je imipramin, doxepin nebo amitriptylin.
04.6 Těhotenství a kojení
Těhotenství
Adekvátní údaje o podávání ranolazinu těhotným ženám nejsou k dispozici. Studie na zvířatech nejsou dostatečné k prokázání účinků na těhotenství a vývoj embrya / plodu (viz bod 5.3). Možné riziko pro člověka není známo. Ranexa by neměla být během těhotenství používána, pokud zjevně nutné.
Čas krmení
Není známo, zda se ranolazin vylučuje do lidského mléka. Vylučování ranolazinu do mléka nebylo studováno na zvířatech.Ranexa by neměla být používána během laktace.
Plodnost
Reprodukční studie na zvířatech neukázaly žádné nežádoucí účinky na plodnost (viz bod 5.3). Účinek ranolazinu na lidskou plodnost není znám.
04.7 Účinky na schopnost řídit a obsluhovat stroje
Nebyly provedeny žádné studie účinků přípravku Ranexa na schopnost řídit a obsluhovat stroje. Ranexa může způsobit závratě, rozmazané vidění, diplopii, stav zmatenosti, abnormální koordinaci a halucinace (viz bod 4.8), které mohou ovlivnit schopnost řídit vozidla a pomocí strojů.
04.8 Nežádoucí účinky
Nežádoucí účinky u pacientů užívajících přípravek Ranexa jsou obvykle mírné nebo středně závažné a často se objevují během prvních dvou týdnů léčby. Byly hlášeny v klinickém vývojovém programu fáze III, zahrnujícím celkem 1030 pacientů s chronickou angínou léčených přípravkem Ranexa.
Níže je uveden seznam nežádoucích účinků, které jsou považovány za přinejmenším pravděpodobně související s léčbou, seřazené podle systému, orgánu a absolutní četnosti. Frekvence jsou definovány jako velmi časté (≥ 1/10), časté (≥ 1/100,
Poruchy metabolismu a výživy
Méně časté: anorexie, snížená chuť k jídlu, dehydratace.
Psychiatrické poruchy
Méně časté: úzkost, nespavost, zmatenost, halucinace.
Vzácný: dezorientace.
Poruchy nervového systému
Běžný: závratě, bolesti hlavy.
Méně časté: letargie, synkopa, hypoestézie, somnolence, třes, posturální závratě, parestézie.
Vzácný: amnézie, snížená úroveň vědomí, ztráta vědomí, abnormální koordinace, abnormální chůze, parosmie.
Oční poruchy
Méně časté: rozmazané vidění, poruchy vidění, diplopie.
Poruchy ucha a labyrintu
Méně časté: vertigo, tinnitus.
Vzácný: poškození sluchu.
Cévní patologie
Méně časté: návaly horka, hypotenze.
Vzácný: nachlazení v končetinách, ortostatická hypotenze.
Respirační, hrudní a mediastinální poruchy
Méně časté: dušnost, kašel, epistaxe.
Vzácný: sevření v krku.
Gastrointestinální poruchy
Běžný: zácpa, zvracení, nevolnost.
Méně časté: bolest břicha, sucho v ústech, dyspepsie, plynatost, žaludeční nevolnost.
Vzácný: pankreatitida, erozivní duodenitida, orální hypoestézie.
Poruchy kůže a podkožní tkáně
Méně časté: svědění, hyperhidróza.
Vzácný: angioedém, alergická dermatitida, kopřivka, studený pot, vyrážka.
Poruchy svalové a kosterní soustavy a pojivové tkáně
Méně časté: bolest končetin, svalové křeče, otoky kloubů.
Poruchy ledvin a močových cest
Méně časté: dysurie, hematurie, chromaturie.
Vzácný: akutní selhání ledvin, retence moči.
Nemoci reprodukčního systému a prsu
Vzácný: erektilní dysfunkce.
Celkové poruchy a reakce v místě aplikace
Běžný: astenie.
Méně časté: únava, periferní edém.
Diagnostické testy
Méně časté: zvýšený kreatinin v krvi, zvýšený dusík močoviny v krvi, prodloužený korigovaný QT interval, zvýšený počet krevních destiček nebo bílých krvinek, úbytek hmotnosti.
Vzácný: zvýšení jaterních enzymů.
Profil nežádoucích účinků byl obecně podobný ve studii MERLIN-TIMI 36. V této dlouhodobé studii bylo také hlášeno akutní selhání ledvin, s incidencí méně než 1% jak u ranolazinu, tak u pacientů léčených placebem. Hodnocení pacientů, kteří by mohli být považováni za nejvíce ohrožené nežádoucími příhodami během léčby jinými antianginózními léčivými přípravky, jako jsou diabetičtí pacienti, pacienti se srdečním selháním třídy I a II nebo s obstrukčním onemocněním dýchacích cest, potvrdili, že tyto stavy nejsou spojeny s klinicky významným zvýšením výskytu nežádoucí příhody.
Starší pacienti s renální insuficiencí nebo podváhou
Obecně se nežádoucí účinky vyskytovaly častěji u starších pacientů a u pacientů s renální insuficiencí; typ událostí v těchto podskupinách byl však podobný událostem pozorovaným v obecné populaci. Mezi nejčastěji hlášenými příhodami se u přípravku Ranexa (opravené frekvence oproti placebu) u starších pacientů (≥ 75 let) častěji vyskytovaly následující než u mladších pacientů (
U pacientů s mírnou nebo středně těžkou poruchou funkce ledvin (clearance kreatininu ≥ 30-80 ml / min) ve srovnání s pacienty s normální funkcí ledvin (clearance kreatininu> 80 ml / min) patří mezi nejčastěji hlášené příhody, frekvence korigované ve srovnání s placebem, tyto: zácpa (8% vs 4%), závratě (7% vs 5%) a nevolnost (4% vs 2%).
Obecně byl typ a frekvence nežádoucích účinků hlášených pacienty s nízkou tělesnou hmotností (≤ 60 kg) podobný jako u pacientů s vyšší tělesnou hmotností (> 60 kg); Nicméně, placebem korigované frekvence následujících běžných nežádoucích účinků byly vyšší u pacientů s nízkou hmotností než u pacientů s vyšší hmotností: nauzea (14% vs. 2%), zvracení (6% vs 1%) a hypotenze (4% vs 2%).
Laboratorní výsledky
U zdravých subjektů a pacientů léčených přípravkem Ranexa byla pozorována malá reverzibilní zvýšení hladin kreatininu v séru, která nemají žádný klinický význam, bez související renální toxicity. Studie renálních funkcí u zdravých dobrovolníků prokázala snížení clearance kreatininu bez změny rychlosti glomerulární filtrace, kompatibilní s inhibicí sekrece kreatininu v renálních tubulech.
04.9 Předávkování
Ve studii orální snášenlivosti vysokých dávek u pacientů s angínou se výskyt závratí, nevolnosti a zvracení zvýšil způsobem závislým na dávce. Kromě těchto nežádoucích účinků ve studii s intravenózním předávkováním u zdravých dobrovolníků. Diplopie, letargie a synkopa byly pozorovány V případě předávkování by měl být pacient pečlivě sledován a měla by mu být poskytnuta symptomatická a podpůrná léčba.
Přibližně 62% ranolazinu se váže na plazmatické proteiny, a proto je úplná clearance hemodialýzou nepravděpodobná.
05.0 FARMAKOLOGICKÉ VLASTNOSTI
05.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: jiné srdeční přípravky, ATC kód: C01EB18
Mechanismus účinku
Mechanismus účinku ranolazinu je do značné míry neznámý.Některé z antianginálních účinků ranolazinu mohou vyplývat z inhibice pozdního sodíkového proudu v srdečních buňkách, což by snížilo intracelulární akumulaci sodíku a následně snížilo intracelulární přetížení vápníku Snížením pozdního sodíkového proudu ranolazin Předpokládá se, že snižuje tyto intracelulární iontové nerovnováhy během ischémie. Předpokládá se, že toto snížení intracelulárního přetížení vápníkem zlepšuje relaxaci myokardu, a proto vede k menší tuhosti levé komory v diastole. Klinický důkaz pozdní inhibice proudu sodíku ranolazinem poskytuje otevřená studie u 5 pacientů se syndromem dlouhého QT (LQT3 s genovou mutací SCN5A δKPQ) vykazující významné zkrácení QTc intervalu a zlepšení diastolické relaxace.
Tyto účinky nesouvisejí se změnami srdeční frekvence nebo krevního tlaku nebo vazodilatací.
Farmakodynamické účinky
Hemodynamické efekty
Minimální snížení průměrné srdeční frekvence (tepů za minutu) a průměrného systolického krevního tlaku (
Elektrokardiografické efekty
U pacientů léčených přípravkem Ranexa bylo pozorováno prodloužení QTc intervalu související s dávkou a plazmatickou koncentrací (přibližně 6 ms s 1000 mg dvakrát denně), snížení amplitudy T vlny a v některých případech vrubové T vlny. Domnívá se, že tyto účinky ranolazinu na povrchový elektrokardiogram jsou důsledkem inhibice rychlého rektifikačního proudu draslíku, který prodlužuje ventrikulární akční potenciál, a inhibice pozdního sodíkového proudu, který zkracuje ventrikulární akční potenciál. "Populační analýza souhrnných údajů od 1308 pacientů a zdravých dobrovolníků ukázala průměrné zvýšení QTc oproti výchozímu stavu o 2,4 ms pro plazmatickou koncentraci ranolazinu 1 000 ng / ml. Tato hodnota je v souladu s klíčovými údaji z klinických studií, ve kterých průměrné změny oproti výchozím hodnotám QTcF (Fridericia's Correction) po dávkách v rozmezí od 500 do 750 mg dvakrát denně byly 1,9 a 4,9 ms, v tomto pořadí. Gradient je zvýšený u pacientů s klinicky významnou jaterní insuficiencí.
Ve velké studii výsledků (MERLIN-TIMI 36) u 6 560 pacientů s ACS UA / NSTEMI nebyl žádný rozdíl mezi přípravkem Ranexa a placebem v riziku úmrtnosti ze všech příčin (relativní riziko ranolazinu: placebo 0,99), náhlé srdeční smrti (relativní riziko ranolazinu: placebo 0,87) nebo ve frekvenci dokumentovaných symptomatických arytmií (3,0% vs. 3,1%).
Ve studii MERLIN-TIMI 36 nebyly pozorovány žádné proarytmické účinky u 3162 pacientů léčených přípravkem Ranexa na základě 7denního Holterova monitorování. Výskyt arytmií byl významně nižší u pacientů léčených přípravkem Ranexa (80%) než u pacientů léčených placebem (87%), včetně ventrikulární tachykardie ≥ 8 tepů (5%vs 8%).
Klinická účinnost a bezpečnost
Klinické studie prokázaly účinnost a bezpečnost přípravku Ranexa při léčbě pacientů s chronickou anginou pectoris, a to buď samostatně, nebo v případech, kdy přínos získaný jinými antianginózními léky nebyl optimální.
V pivotní studii CARISA byla Ranexa přidána k léčbě atenololem 50 mg denně, amlodipinem 5 mg denně nebo diltiazemem 180 mg denně. Osm set dvacet tři pacientů (23% žen) bylo randomizováno buď na 750 mg dvakrát denně nebo 1000 mg dvakrát denně na přípravek Ranexa nebo na placebo po dobu 12 týdnů. V obou dávkách byl přípravek Ranexa, používaný jako doplňková terapie, účinnější než placebo při prodloužení trvání cvičení v bodě minima na 12 týdnů, ale mezi těmito dvěma dávkami nebyly žádné rozdíly v délce cvičení (24 sekund oproti placebu) ; p ≤ 0,03).
Ranexa měla za následek významné snížení počtu záchvatů anginy pectoris za týden a spotřeby rychle působícího nitroglycerinu ve srovnání s placebem. Během léčby se nevyvinula žádná tolerance k ranolazinu a po náhlém přerušení nebyl pozorován nárůst rebound záchvatů anginy pectoris. Při dávce 1 000 mg dvakrát denně bylo zlepšení délky cvičení u žen přibližně 33% zlepšení u mužů. Muži a ženy však zaznamenali podobné snížení četnosti záchvatů anginy pectoris a spotřeby nitroglycerinu. S ohledem na dávkově závislé vedlejší účinky a podobnou účinnost při 750 a 1 000 mg dvakrát denně se doporučuje maximální dávka 750 mg dvakrát denně.
Ve druhé studii s názvem ERICA byl přípravek Ranexa přidán k léčbě amlodipinem 10 mg denně (maximální indikovaná dávka). Pět set šedesát pět pacientů bylo randomizováno k počáteční léčbě přípravkem Ranexa v dávce 500 mg dvakrát denně nebo placebem po dobu 1 týdne, po které následovalo 6 týdnů léčby přípravkem Ranexa v dávce 1000 mg dvakrát denně nebo placebem přidání k souběžné léčbě amlodipinem 10 mg denně. Kromě toho 45% studované populace užívalo také dlouhodobě působící dusičnany. Ranexa měla za následek významné snížení počtu záchvatů anginy pectoris za týden (p = 0,028) a spotřeby rychle působícího nitroglycerinu (p = 0,014) ve srovnání s placebem. Průměrný počet záchvatů anginy pectoris a počtu spotřebovaných tablet s nitroglycerinem klesl na přibližně jeden za týden.
V hlavní studii zjišťování dávek nazvané MARISA byl ranolazin použit samostatně. Sto devadesát jedna pacientů bylo randomizováno k léčbě přípravkem Ranexa v dávce 500 mg dvakrát denně, 1 000 mg dvakrát denně, 1 500 mg dvakrát denně a odpovídajícímu placebu po dobu 1 týdne každý s křížením. Ranexa byla ve všech studovaných dávkách významně lepší než placebo v prodloužení doby cvičení, času do anginy a času do 1 mm deprese ST segmentu; byla pozorována korelace mezi dávkou a odpovědí.Zlepšení v délce cvičení bylo statisticky významné ve srovnání s placebem u všech tří dávek ranolazinu, od 24 sekund s 500 mg dvakrát denně do 46 sekund s 1500 mg dvakrát denně, což ukazuje odpověď související s dávkou. V této studii byla maximální doba cvičení bylo dosaženo ve skupině 1 500 mg; to však vedlo k nadměrnému nárůstu nežádoucích účinků, takže dávka 1500 mg nebyla dále zkoumána.
Ve velké studii výsledků (MERLIN-TIMI 36) nebyl u 6 560 pacientů s ACS UA / NSTEMI žádný rozdíl v riziku mortality ze všech příčin (relativní riziko ranolazin: placebo 0,99), náhlé srdeční smrti (relativní riziko ranolazin: placebo 0,87) nebo ve frekvenci dokumentovaných symptomatických arytmií (3,0% vs. 3,1%) mezi přípravkem Ranexa a placebem při přidání ke standardní lékařské terapii (beta-blokátory, blokátory kalciových kanálů, dusičnany, protidestičkové látky, látky snižující hladinu lipidů a ACE inhibitory) . Ve studii MERLIN-TIMI 36 měla přibližně polovina pacientů anamnézu anginy pectoris. Výsledky ukázaly, že cvičení bylo o 31 sekund delší u pacientů užívajících ranolazin než u pacientů užívajících placebo (p = 0,002). Seattle Angina Questionnaire prokázal významné účinky na několik aspektů, včetně frekvence anginy pectoris (str
V kontrolovaných klinických studiích byli nekaukazané zastoupeni v omezeném poměru, takže nelze vyvodit žádné závěry ohledně účinnosti a bezpečnosti v této kategorii pacientů.
05.2 Farmakokinetické vlastnosti
Po perorálním podání jsou vrcholové koncentrace Ranexy (Cmax) obvykle pozorovány s odstupem 2 až 6 hodin. Ustáleného stavu je obvykle dosaženo během 3 dnů při podávání dvakrát denně.
Vstřebávání
Po perorálním podání ranolazinových tablet s okamžitým uvolňováním byla průměrná absolutní biologická dostupnost mezi 35 a 50%se „širokou interindividuální variabilitou“. Expozice Ranexy se zvyšuje více než úměrně dávce. Zvýšením dávky z 500 mg na 1 000 mg dvakrát denně se AUC v ustáleném stavu zvýšila 2,5–3krát. Ve farmakokinetické studii u zdravých dobrovolníků byla po podání 500 mg dvakrát denně průměrná Cmax v ustáleném stavu 1770 (SD 1040) ng / ml a AUC0-12 v ustáleném stavu průměrně 13 700 (SD 8290) ng xh / ml. Jídlo neovlivňuje rychlost a rozsah absorpce ranolazinu.
Rozdělení
Přibližně 62% ranolazinu se váže na plazmatické proteiny, převážně na alfa-1 kyselý glykoprotein a slabě na albumin. Průměrný distribuční objem v ustáleném stavu (Vss) je přibližně 180 litrů.
Odstranění
Ranolazin je eliminován převážně metabolismem. Méně než 5% dávky se vylučuje v nezměněné formě močí a stolicí. Po orálním podání jedné dávky 500 mg [14C] -ranolazinu zdravým dobrovolníkům bylo 73% radioaktivity zachyceno v moči a 25% ve stolici.
Clearance ranolazinu je závislá na dávce a klesá, jak se „zvyšuje“. Eliminační poločas po intravenózním podání je přibližně 2-3 hodiny. Terminální poločas v ustáleném stavu po perorálním podání ranolazinu je přibližně 7 hodin, protože eliminace je omezena rychlostí absorpce.
Biotransformace
Ranolazin je rychle a rozsáhle metabolizován. U zdravých mladých dospělých představuje ranolazin přibližně 13% radioaktivity v plazmě po jednorázovém perorálním podání 500 mg [14C] -ranolazinu. U lidí bylo v plazmě, moči (více než 100) a stolici identifikováno několik metabolitů. Bylo identifikováno 14 hlavních cest, z nichž nejdůležitější jsou O-demetylace a N-dealkylace. In vitro Studie na lidských jaterních mikrozomech naznačují, že ranolazin je metabolizován primárně CYP3A4, ale také CYP2D6. Při dávce 500 mg dvakrát denně vykazovali subjekty se slabou aktivitou CYP2D6 (pomalí metabolizátoři, ML) o 62% vyšší AUC než subjekty s dobrými metabolizéry CYP2D6 (extenzivní metabolizátoři, MR). Odpovídající rozdíl při dávce 1000 mg dvakrát denně byl 25 %.
Zvláštní populace pacientů
Vliv několika faktorů na farmakokinetiku ranolazinu byl zkoumán v populačním farmakokinetickém hodnocení u 928 pacientů s angínou a zdravých jedinců.
Typ: pohlaví nevykázalo žádné klinicky relevantní účinky na farmakokinetické parametry.
Starší pacienti: Věk sám o sobě neprokázal klinicky relevantní účinky na farmakokinetické parametry, ale expozice ranolazinu se u starších osob může zvýšit v důsledku snížení funkce ledvin souvisejícího s věkem.
Tělesná hmotnost: Ve srovnání s subjekty s tělesnou hmotností 70 kg byla expozice odhadována přibližně 1,4krát vyšší u subjektů s tělesnou hmotností 40 kg.
SCC: v SCHA NYHA třídy III a IV byly plazmatické koncentrace odhadnuty přibližně 1,3krát vyšší.
Selhání ledvin: Ve studii hodnotící vliv funkce ledvin na farmakokinetiku ranolazinu byla AUC ranolazinu v průměru 1,7–2krát vyšší u subjektů s mírnou, středně těžkou a těžkou poruchou funkce ledvin než u subjektů s normální funkcí ledvin. U subjektů s renální insuficiencí byla pozorována „velká interindividuální variabilita“ v AUC. AUC metabolitů se zvyšovala se sníženou funkcí ledvin.AUC farmakologicky aktivního metabolitu ranolazinu se zvýšila 5krát u pacientů s těžkou poruchou funkce ledvin.
V populační farmakokinetické analýze bylo odhadnuto 1,2násobné zvýšení expozice ranolazinu u subjektů se středně těžkou poruchou (clearance kreatininu 40 ml / min). U subjektů s těžkou renální insuficiencí (clearance kreatininu 10-30 ml / min) bylo odhadnuto 1,3 až 1,8násobné zvýšení expozice ranolazinu.
Vliv dialýzy na farmakokinetiku ranolazinu nebyl hodnocen.
Jaterní nedostatečnostFarmakokinetika ranolazinu byla hodnocena u pacientů s lehkou nebo středně těžkou poruchou funkce jater. U pacientů s těžkou poruchou funkce jater nejsou k dispozici žádné údaje. AUC ranolazinu byla u pacientů s mírnou poruchou funkce jater nezměněna, ale u pacientů se středně těžkou poruchou funkce se zvýšila 1,8krát. Prodloužení QT bylo u těchto pacientů výraznější.
Pediatrická populaceFarmakokinetické parametry ranolazinu nebyly u pediatrické populace studovány (
05.3 Předklinické údaje vztahující se k bezpečnosti
Nežádoucí reakce, které nebyly pozorovány v klinických studiích, ale byly zjištěny u zvířat v hladinách podobných těm, které byly vystaveny klinické expozici, jsou následující: u potkanů a psů byl ranolazin spojen s křečemi a zvýšenou úmrtností při přibližně trojnásobných plazmatických koncentracích. Vyšší než maximální navrhovaná klinická dávka.
Studie chronické toxicity na potkanech ukázaly, že léčba je spojena s nadledvinovými změnami, u expozic mírně vyšších, než jaké byly pozorovány u pacientů. Tento účinek je spojen se zvýšením plazmatických koncentrací cholesterolu. U člověka nebyly identifikovány žádné podobné změny nebo účinky na adrenokortikální osu.
V dlouhodobých studiích kancerogenity s dávkami ranolazinu až 50 mg / kg / den (150 mg / m2 / den) u myší a až 150 mg / kg / den (900 mg / m2 / den) u potkanů nejsou významná zvýšení byly pozorovány incidenty rakoviny jakéhokoli typu. V mg / m2 jsou tyto dávky 0,1, respektive 0,8násobek maximální doporučené dávky pro člověka 2 gramy a představují maximální tolerované dávky u lidí. těchto druhů.
Známky embryonální a mateřské toxicity, nikoli však teratogenity, byly pozorovány u dávek ranolazinu až 400 mg / kg / den (2400 mg / m2 / den) u potkanů a až 150 mg / kg / den (1800 mg / den) . m2 / den) u králíka. Tyto dávky odpovídají 2,7 respektive 2násobku maximální doporučené dávky pro člověka.
Studie na zvířatech nenaznačují přímé ani nepřímé škodlivé účinky ranolazinu na mužskou nebo ženskou plodnost.
06.0 FARMACEUTICKÉ INFORMACE
06.1 Pomocné látky
Pomocné látky pro všechny tablety ranolazinu s prodlouženým uvolňováním:
karnaubský vosk
hypromelóza
stearát hořečnatý
kopolymer ethylakrylátu a kyseliny methakrylové (1: 1)
mikrokrystalická celulóza
hydroxid sodný
oxid titaničitý
Další pomocné látky pro 375 mg tabletu:
makrogol
polysorbát 80
modrá n. 2 / E132 hlinitý lak indigokarmínu
06.2 Neslučitelnost
Irelevantní.
06.3 Doba platnosti
Blistrové balení: 5 let.
Láhev: 4 roky.
06.4 Zvláštní opatření pro skladování
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
06.5 Charakter vnitřního obalu a obsah balení
PVC / PVDC / hliníkový blistr po 10 tabletách v blistru. Každý karton obsahuje 3, 6 nebo 10 blistrů (30, 60 nebo 100 tablet) nebo HDPE lahvičku se 60 tabletami.
Na trhu nemusí být všechny velikosti balení.
06.6 Návod k použití a zacházení
Žádné zvláštní pokyny
07.0 DRŽITEL ROZHODNUTÍ O REGISTRACI
Menarini International Operations Luxembourg S.A.
1, Avenue de la Gare, L-1611 Luxembourg
Lucembursko
08.0 REGISTRAČNÍ ČÍSLO
EU/1/08/462/001 60 tablet v blistru - AIC: 038917011
EU/1/08/462/002 60 tablet v lahvičce - AIC: 038917023
EU/1/08/462/007 30 tablet v blistru - AIC: 038917074
EU/1/08/462/008 100 tablet v blistru - AIC: 038917086
09.0 DATUM PRVNÍ REGISTRACE NEBO PRODLOUŽENÍ REGISTRACE
Datum první registrace: 9. července 2008
Datum posledního prodloužení: 6. března 2013
10.0 DATUM REVIZE TEXTU
duben 2013













.jpg)